
- Investment
- 科学论坛
-
Program
- Recruitment
- Center
News Message
Science 最新进展
- by wittx 2021-10-24
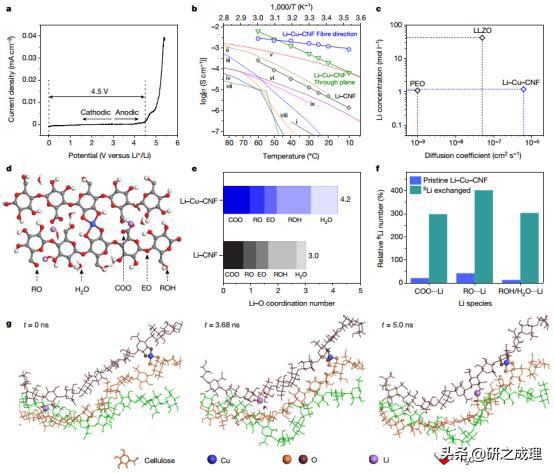
1.Science:特定肠道细菌可导致前列腺癌生长和激素治疗抗性
doi:10.1126/science.abf8403
在一项新的研究中,来自瑞士意大利语区大学、瑞士南部肿瘤研究所和英国伦敦癌症研究所等研究机构的研究人员发现常见的肠道细菌可以促进前列腺癌的生长,并使这种癌症能够逃避治疗的影响。他们揭示了肠道细菌通过提供促进生长的雄激素的替代来源如何促进晚期前列腺癌的进展以及它们对激素疗法的抵抗。相关研究结果发表在2021年10月8日的Science期刊上,论文标题为“Commensal bacteria promote endocrine resistance in prostate cancer through androgen biosynthesis”。
图片来自Unsplash/CC0 Public Domain。
激素疗法是晚期前列腺癌的标准治疗方法,通过降低雄激素的水平而发挥作用。但是,这些作者发现,患者体内的低雄激素水平可以推动肠道细菌的扩张,这些肠道细菌可以成为维持前列腺癌生长的激素工厂。
鉴于这些“肠道细菌”在癌症中可能发挥的作用,这些作者研究了患有前列腺癌的男性患者的肠道细菌是否也能改变患者的激素代谢,从而影响癌症的生长。他们发现,在患有前列腺癌的小鼠身上清除所有的肠道细菌,可以减缓肿瘤的生长,并推迟激素抵抗的出现。他们还发现,将患有激素抵抗性前列腺癌的小鼠的粪便移植到尚未出现激素抵抗性的低雄激素水平的小鼠身上,会促进肿瘤的生长。他们在小鼠身上证实,肠道细菌能够利用前体分子制造雄激素。
为了将这些研究结果转化为人类,这些作者分析了正在英国皇家马斯登NHS基金会信托医院(The Royal Marsden NHS Foundation Trust)接受治疗的患者的肠道细菌。他们研究了两组不同的患者---19名所患前列腺癌对激素治疗仍有反应的男性和55名患有晚期激素抵抗性前列腺癌的男性。将激素抵抗性前列腺癌患者的粪便移植到所患前列腺癌没有激素抵抗性的小鼠身上,促进了肿瘤的生长和激素抵抗性。他们还分析了前列腺癌男性患者粪便中的微生物遗传物质,并确定了一种特定的细菌---瘤胃球菌(Ruminococcus)---可能在激素抵抗性的产生中发挥了重要作用。相比之下,粪普雷沃氏菌(Prevotella stercorea)与有利的临床结果有关。
2.Science:短脉冲电刺激苍白球中特定神经元亚群延长了脑深部刺激的治疗益处
doi:10.1126/science.abi7852
在一项新的研究中,来自美国卡内基梅隆大学的研究人员找到了一种使脑深部刺激(deep brain stimulation, DBS)更加精确的方法,从而使治疗效果超过目前可用的治疗方法。这一发现将极大地推动帕金森病研究。相关研究结果发表在2021年10月8日的Science期刊上,论文标题为“Commensal bacteria promote endocrine resistance in prostate cancer through androgen biosynthesis”。论文通讯作者为卡内基梅隆大学生物科学副教授Aryn Gittis。
Gittis在2017年为这种治疗方法奠定了基础,当时她的实验室确定了大脑运动回路中的特定类别的神经元,靶向这些神经元可为帕金森病模型中的运动症状提供持久的缓解。在这项新的研究中,Gittis实验室使用了光遗传学,这是一种利用光来控制经过基因改造的神经元的技术。然而,光遗传学目前不能用于人类。从那时起,她一直在努力寻找一种更容易转化为帕金森病患者的策略。她的团队在小鼠身上发现了一种新的DBS方案,该方案使用短脉冲电刺激。
Gittis说,“与其他现有的治疗方法相比,这是一个很大的进步。在其他DBS方案中,一旦关闭电刺激,症状就会回来。这种新的DBS方案似乎能提供更持久的益处---持续时间至少比传统DBS长四倍。”
在这种新的DBS方案中,这些作者针对苍白球(globus pallidus)---大脑基底神经节中的一个区域---中的特定神经元亚群进行短脉冲电刺激。Gittis说,科学家们多年来一直试图找到以这种细胞类型特异性的方式提供刺激的方法。她说,“这个概念并不新鲜。我们使用了一种‘自下而上’的方法来驱动细胞类型的特异性。我们研究了这种细胞类型的生物学,确定了驱动它们的信号输入。我们找到了一个让我们可以利用基础生物学的最佳点。”
3.Science:在试管中重建完整的生物钟并研究它的工作机制
doi:10.1126/science.abd4453
我们生理机理的几乎每一个方面的日周期(daily cycle)都是由我们细胞中的生物钟(biological clock)---也称为昼夜节律钟(circadian clock)---驱动的。生物钟蛋白(clock protein)的周期性相互作用使生命的生物节律与白天和黑夜的日周期保持一致,这不仅发生在人类和其他复杂的动物身上,甚至发生在简单的单细胞生物中,如蓝细菌(即蓝藻)。
在一项新的研究中,来自美国加州大学圣克鲁兹分校、加州大学默塞德分校和加州大学圣地亚哥分校的研究人在试管中重建了蓝藻的昼夜节律钟,使他们能够实时研究生物钟蛋白的节律性相互作用,并了解这些相互作用如何使生物钟对基因表达施加控制。相关研究结果发表在2021年10月8日的Science期刊上,论文标题为“Reconstitution of an intact clock reveals mechanisms of circadian timekeeping”。
在体外重建完整的生物钟,图片来自Science, 2021, doi:10.1126/science.abd4453。
这项新研究建立在日本研究人员以前的研究工作---在2005年重建了蓝藻昼夜节律振荡器(circadian oscillator),即生物钟的基本24小时计时回路---的基础之上。该昼夜节律振荡器由三种相关蛋白组成:KaiA、KaiB和KaiC。在活细胞中,来自这种昼夜节律振荡器的信号通过其他蛋白传递,以控制昼夜循环中的基因表达。
这种新的体外生物钟除了这三种昼夜节律振荡器蛋白外,还包括两种激酶蛋白(SasA和CikA)以及一种DNA结合蛋白(RpaA)及其DNA靶标。这两种激酶蛋白的活性通过与这种昼夜节律振荡器相互作用而改变。
LiWang解释说,“SasA和CikA分别激活RpaA和使RpaA失活,使其有节律地结合和不结合DNA。在蓝藻中,这种在其基因组中100多个不同位点的有节律的结合和不结合,激活和抑制了许多对健康和生存重要的基因的表达。”
利用荧光标记技术,这些作者能够跟踪所有这些生物钟组分之间的相互作用,因为这整个系统在许多天甚至几周内都伴随着昼夜节律振荡。该系统使得他们能够确定SasA和CikA如何增强这种昼夜节律振荡器的稳健性,从而在KaiABC蛋白本身会停止振荡的条件下保持它的运行。
4.Science:新研究追溯了乙肝病毒从史前到现在的进化过程
doi:10.1126/science.abi5658
在一项新的研究中,来自德国、俄罗斯和西班牙等多个国家的研究人员通过分析迄今为止产生的最大的古代病毒基因组数据集,揭示了自全新世早期以来乙型肝炎病毒(HBV)的演变。相关研究结果发表在2021年10月8日的Science期刊上,论文标题为“Ten millennia of hepatitis B virus evolution”。
HBV是世界范围内的一个主要健康问题,每年造成近一百万人死亡。最近的古代DNA研究表明,HBV感染人类已经有几千年的历史,但是它过去的多样性和传播路线在很大程度上仍然是未知的。这项新的研究通过检查137个可追溯到~10,500年前和~400年前之间的古代欧亚人和美洲原住民的病毒基因组,对HBV的进化历史提供了重要的新见解。他们的研究结果突出了HBV的传播路线和病毒多样性变化,反映了众所周知的人类迁移和人口事件,以及意想不到的模式和与现在的联系。
5.Science:先前接触过普通感冒冠状病毒可增强人体对SARS-CoV-2的免疫反应
doi:10.1126/science.abh1823
在一项新的研究中,来自德国柏林夏里特医学院、柏林卫生研究所和马克斯-普朗克分子遗传学研究所的研究人员发现,在以前接触过普通感冒冠状病毒的人身上发现的某些免疫细胞在自然感染期间和接种疫苗后都能增强人体对SARS-CoV-2的免疫反应。他们还报告说,这种“交叉免疫反应”随着年龄的增长而减少。这一现象可能有助于解释为什么老年人更容易受到严重疾病的影响,以及为什么他们接种的疫苗诱导的免疫力往往比年轻人要弱。相关研究结果于2021年8月31日在线发表在Science期刊上,论文标题为“Cross-reactive CD4+ T cells enhance SARS-CoV-2 immune responses upon infection and vaccination”。
CD4+ T细胞对SARS-CoV-2 ORFeome的交叉反应性,图片来自Science, 2021, doi:10.1126/science.abh1823。
去年,这些研究人员有了一项惊人的发现(Nature, 2020, doi:10.1038/s41586-020-2598-9)。他们首次报告说,以前没有接触过SARS-CoV-2的人也有能够识别这种新型冠状病毒的免疫记忆细胞:辅助性T细胞。他们得出结论,这些辅助性T细胞一定是为了对付大多数无害的普通感冒冠状病毒而产生的,并且由于冠状病毒之间的结构相似(特别是在其外表面发现的特征性刺突蛋白),它们也将攻击新型冠状病毒。这种“交叉免疫反应”假说后来被一系列研究证实。
然而,仍然不清楚的是,这些免疫记忆细胞是否会影响随后的SARS-CoV-2感染的过程,这也是激烈辩论的对象。论文第一作者、柏林卫生研究所的Lucie Loyal博士说,“我们当时的假设是,交叉反应性的辅助性T细胞具有保护作用,因此,事先接触长期存在和广泛流通的普通感冒冠状病毒会降低COVID-19症状的严重性。然而,事实可能恰恰相反。对于某些病毒,涉及类似毒株的第二次感染可能导致错误的免疫反应,并对临床过程产生负面影响。”在这项新的研究中,这些作者提出了证据,支持他们之前关于存在保护作用的假设。根据他们的数据,交叉免疫反应可能是在COVID-19患者体内观察到的疾病严重程度变化的几个原因之一,但也可能解释了在不同年龄组所看到的疫苗效力的差异。
在这项新的研究中,这些作者招募了之前没有接触过SARS-CoV-2的人,定期对他们进行测试,以确定他们是否感染了这种冠状病毒。在从2020年中期开始招募的总共近800名参与者中,有17人检测结果呈阳性。他们详细研究了这些感染者的免疫系统。他们的分析表明,针对SARS-CoV-2的免疫反应还包括调动在应对流行性普通感冒冠状病毒时产生的辅助性T细胞。他们还发现,针对SARS-CoV-2的免疫反应的质量与感染前存在于体内的交叉反应细胞的数量有关。这些辅助性T细胞特别有效地识别刺突蛋白的特定区域。在流行性普通感冒冠状病毒和这种新型冠状病毒中,这个位点的特征是序列相似,具有较好的“保守性”。
6.Science:蛋白RGS3可增强KRAS的GTPase活性
doi:10.1126/science.abf1730
KRAS是多种癌症类型中的一个关键致癌基因,但现有的抑制剂只靶向含有G12C突变的KRAS突变体形式,其功能呈现出一个机制上的难题。众所周知,KRASG12C抑制剂与这种肿瘤蛋白的非活性形式结合;然而,诸如G12C之类的KRAS突变干扰了通常帮助它水解GTP以达到非活性状态的蛋白的作用。Li等人如今已经确定了一种能增强突变KRAS突变体的GTP水解的蛋白---RGS3,这有助于解释目前靶向这种肿瘤蛋白的药物的临床活性。
7.Science:揭示贻贝产生一种蛋白粘合剂的细胞机制
doi:10.1126/science.abi9702
贻贝产生了一种特殊的蛋白粘合剂,因此它们可以抵御波浪和水流。与修饰的酪氨酸残基结合的金属离子在强化这种蛋白粘合剂方面发挥了重要作用。Priemel等人汇集了多种光谱学和显微镜技术来研究贻贝产生这种蛋白粘合剂的细胞机制。他们发现,富含金属离子的囊泡与含有这种蛋白粘合剂的囊泡一起分泌,并在贻贝足部侧管中发现的相互连接的微通道内以类似微流控的方式混合,形成多孔的粘性斑细丝。(生物谷 Bioon.com)
Share Http URL: http://www.wittx.cn/get_news_message.do?new_id=844

Best Last Month
Information industry by wittxAdvanced Computational Models for the Analysis of Adhesive Friction
.jpg)
Information industry by wittx
.jpg)
Information industry by wittx

Information industry by wittx

Information industry by wittxGoogle’s PaLM-E is a generalist robot brain that takes commands

Information industry by wittx
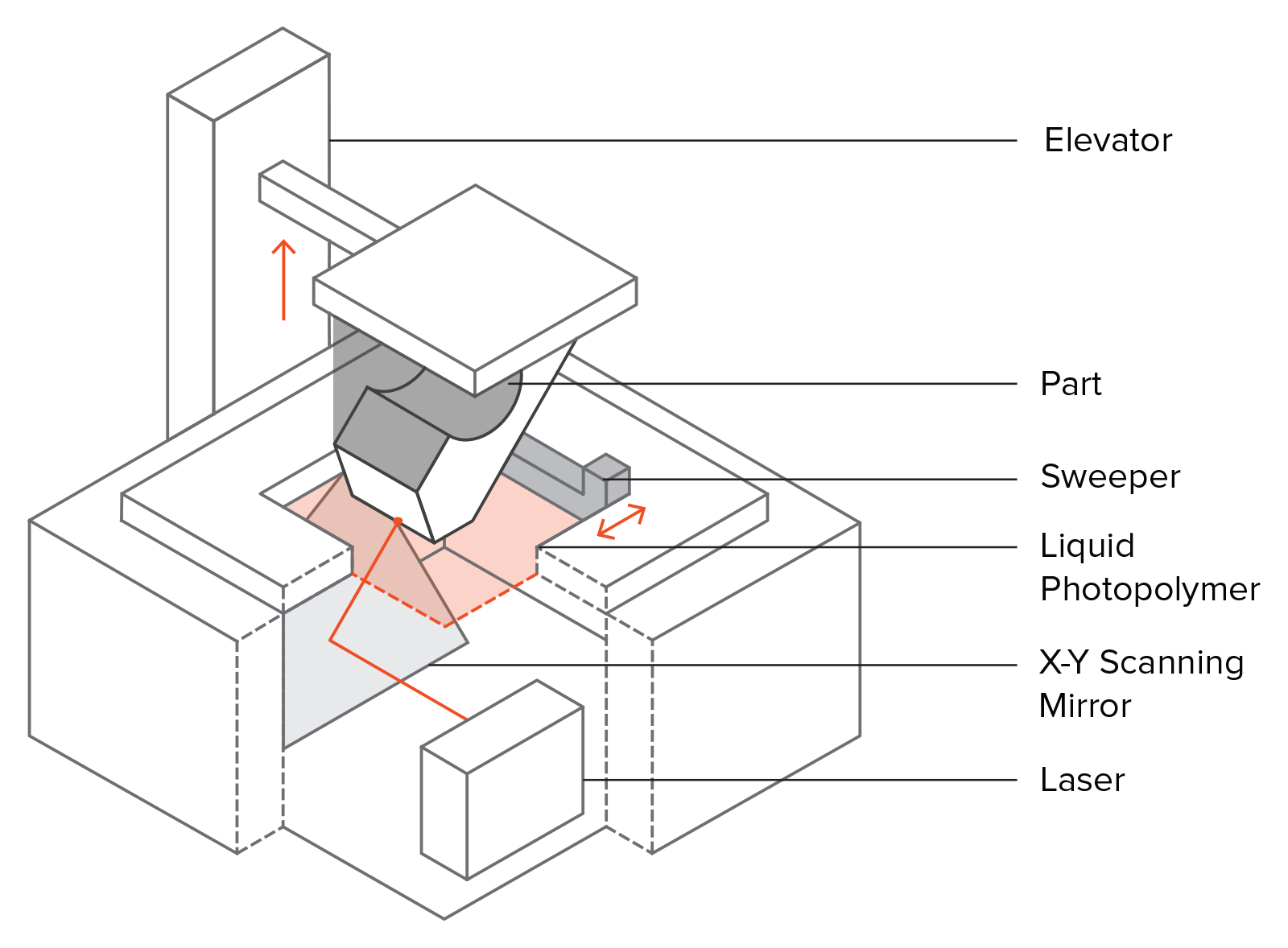
Information industry by wittxRoll-to-roll, high-resolution 3D printing of shape-specific particles

Information industry by wittx
Information industry by wittx

Information industry by wittx
