
- Investment
- 科学论坛
-
Program
- Recruitment
- Center
News Message
Moderna 今日将向美国和欧盟提交新冠疫苗使用许可 股价盘前上涨 11%
- by wittx 2020-11-30
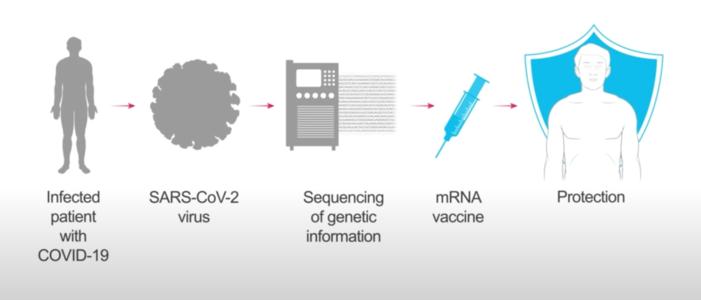
据彭博,Moderna 计划周一向美国和欧洲药监部门申请新冠疫苗紧急使用许可,此前的三期临床试验中期分析显示,该疫苗在有效性和安全性上都超预期。
Moderna 表示,该公司计划周一向 FDA 申请该疫苗在美国的紧急使用许可,并在欧洲向 EMA 申请有条件的上市许可。一周前(11 月 23 日),辉瑞 &BioNTech 研发的新冠疫苗也曾向 FDA 申请类似的紧急使用许可。
Moderna 还表示,FDA 的顾问团可能会在 12 月 17 日的一次公开会议上详细审查这些数据;而在 12 月 10 日,辉瑞的疫苗预计也会进行类似的审查。
受消息影响,Moderna 美股盘前一度大涨 11%。
Moderna 的 CEO Stephane Bancel 表示,过去几周他们一直在不停地工作,以准备好把疫苗数据提交给监管机构。一旦有关部门批准,该公司将迅速采取行动分发数百万剂疫苗。
Bancel 还表示,如果该疫苗在美国获得批准,Moderna 会将全部库存移交到联邦政府,预计到今年年底该公司能向美国运送 2000 万剂疫苗。
此前,Moderna 已经达成协议,将向美国提供 1 亿剂疫苗,向欧盟提供 8000 万剂疫苗。
该公司还表示,最新的分析显示,该疫苗在老年人、年轻人以及少数族裔中效果良好,但 Moderna 没有透露疫苗在这些群体中的确切疗效,Bancel 也表示更详细的数据仍在最后核实验证中。
Moderna 表示,按照 FDA 的要求,该公司还从 3 万多名参与者的最后阶段试验中积累并获取了两个月的安全性相关数据。尤其是注射部位疼痛、疲劳、肌肉或关节疼痛和头痛等副作用的数据。Moderna 说,在二次注射第二剂疫苗后,副作用更加普遍和严重。
Share Http URL: http://www.wittx.cn/get_news_message.do?new_id=592

Best Last Month
Information industry by wittxEmpowering Transformers for Times Series Forecasting with Exogenous Variables

Information industry by wittx

Computer software and hardware by wittx

Traffic by wittx
Information industry by wittx
.jpg)
Computer software and hardware by wittx
Computer software and hardware by wittx
Information industry by wittxA Survey on Recent Progress in the Theory of Evolutionary Algorithms for Discrete Optimization

Information industry by wittx

Information industry by wittx
